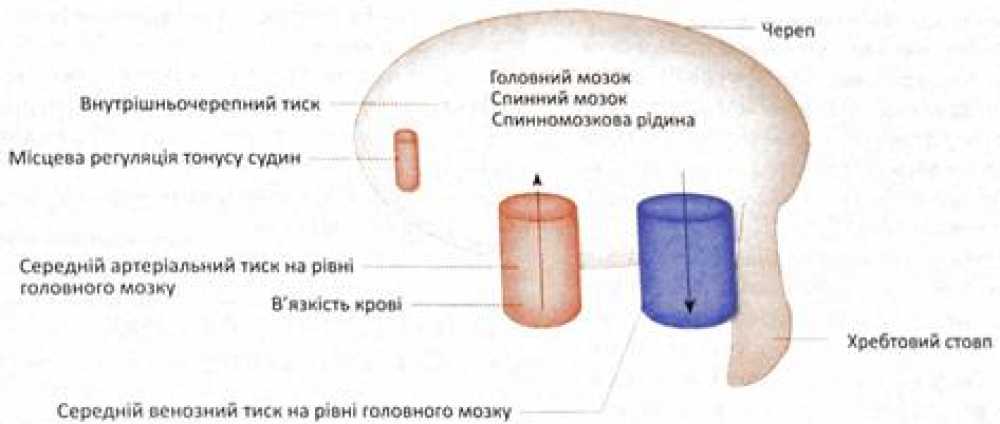
Механізми регуляції мозкового кровообігу
Регуляція мозкового кровообігу здійснюється складною системою, що включає інтра- і екстрацеребральні механізми. Ця система здатна до саморегуляції (тобто може підтримувати кровопостачання головного мозку відповідно до його функціональних та метаболічних потреб і тим самим зберігати постійність внутрішнього середовища), що здійснюється шляхом зміни просвіту мозкових артерій. Ці гомеостатичні механізми, що розвинулися в процесі еволюції, дуже досконалі і надійні. Серед них виділяють такі основні механізми саморегуляції:
- Нервовий.
- Гуморальний.
- Міогенний.
Нервовий механізм передає інформацію про стан об’єкта регулювання за допомогою спеціалізованих рецепторів, розташованих в стінках судин і в тканинах. До них, зокрема, відносяться механорецептори, що локалізуються в кровоносній системі, повідомляють про зміни внутршньосудинного тиску (баро і пресорецептори), в тому числі і пресорецептори каротидного синуса (при їх подразненні розширюються мозкові судини); механорецептори вен і мозкових оболонок, які сигналізують про ступінь їх розтягування при збільшенні кровонаповнення або обсягу мозку; хеморецептори каротидного синуса (при їх подразненні звужуються мозкові судини) і самої тканини мозку, звідки йде інформація про вміст кисню, вуглекислоти, про коливання рН і про інші хімічні зрушення в середовищі при накопиченні продуктів метаболізму або біологічно активних речовин, а також рецептори вестибулярного апарату, аортальної рефлексогенної зони, рефлексогенної зони серця і коронарних судин, ряд пропріорецепторов. Особливо велика роль синокаротидної зони. Вона впливає на мозковий кровообіг не тільки опосередковано (через загальний АТ), як це уявлялося раніше, а й безпосередньо. Денервації і новокаинизации цієї зони в експерименті, усуваючи судинозвужувальні впливу, веде до розширення мозкових судин, до посилення кровопостачання головного мозку, до підвищення в ньому напруги кисню.
Гуморальний механізм полягає в прямому впливі на стінки судин-ефекторів гуморальних факторів (кисню, вуглекислоти, кислих продуктів метаболізму, іонів К і ін.) шляхом дифузії фізіологічно активних речовин в стінку судин. Так, мозковий кровообіг посилюється при зменшенні вмісту кисню і/або збільшення вмісту вуглекислого газу в крові і, навпаки, послаблюється, коли вміст газів в крові змінюється в протилежному напрямку. При цьому відбувається рефлекторна дилатація або констрикція судин в результаті подразнення хеморецепторів відповідних артерій мозку при зміні змісту в крові кисню і вуглекислоти. Можливий і механізм аксонрефлекса.
Міогенний механізм реалізується на рівні судин-ефекторів. При їх розтягуванні тонус гладких м’язів зростає, а при скороченні, навпаки, знижується. Міогенні реакції можуть сприяти змінам судинного тонусу в певному напрямку.
Різні механізми регуляції діють не ізольовано, а в різних поєднаннях один з одним. Система регулювання підтримує постійний кровотік в мозку на достатньому рівні і швидко змінює його при впливі різних чинників.
Таким чином, поняття «судинні механізми» включає структурні і функціональні особливості відповідних артерій або їх сегментів (локалізацію в мікроциркуляторній системі, калібр, будову стінок, реакції на різноманітні впливи), а також їх функціональну поведінку - специфічну участь в тих чи інших видах регуляції периферичного кровообігу і мікроциркуляції.
З’ясування структурно-функціональної організації судинної системи головного мозку дозволило сформулювати концепцію про внутрішні (автономні) механізми регуляції мозкового кровообігу при різних впливах. Відповідно до цієї концепції, зокрема, були виділені: «замикальний механізм» магістральних артерій, механізм піальних артерій, механізм регуляції відтоку крові з венозних синусів мозку, механізм внутрішньомозкових артерій.
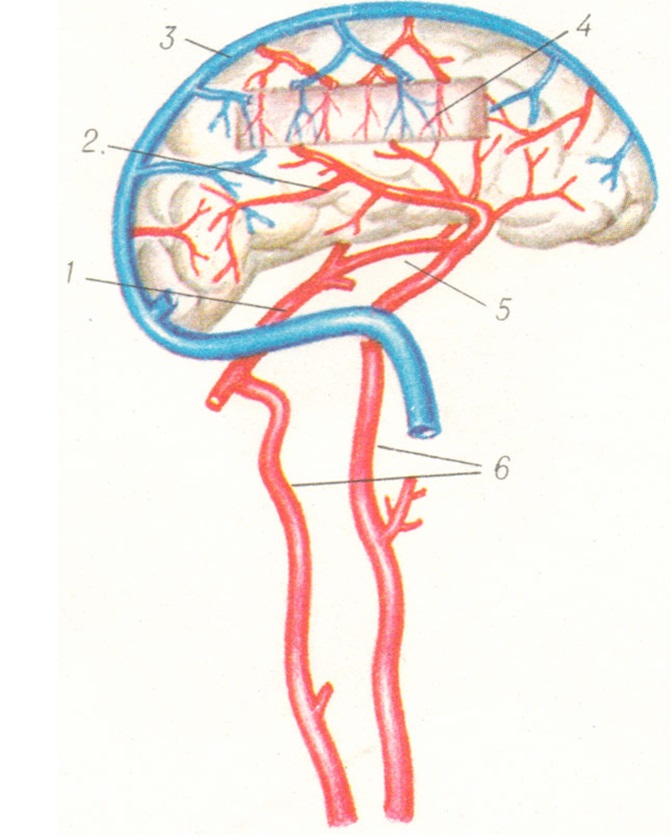
«Замикальний» механізм магістральних артерій підтримує в мозку сталість кровотоку при змінах рівня загального артеріального тиску. Це здійснюється шляхом активних змін просвіту мозкових судин - їх звуження, що збільшує опір кровотоку при підвищенні загального артеріального тиску і, навпаки, розширення, котре знижує цереброваскулярний опір при падінні загального артеріального тиску. Як констрикторна, так і ділататорна реакції виникають рефлекторно з екстракраніальних пресорецепторів або з рецепторів самого мозку. Основними ефекторами в таких випадках є внутрішні сонні та хребетні артерії. Завдяки активним змінам тонусу магістральних артерій гасяться дихальні коливання загального артеріального тиску, а також хвилі Траубе-Герінга, і тоді кровотік в судинах мозку залишається рівномірним.
Якщо ж зміни загального АТ дуже значні або механізм магістральних артерій недосконалий, внаслідок чого порушується адекватне кровопостачання головного мозку, то настає другий етап саморегуляції - включається механізм піальних артерій, що реагує аналогічно механізму магістральних артерій.
Весь цей процес багатоланцюговий. Основну роль в ньому грає нейрогенний механізм, проте певне значення мають і особливості функціонування гладком’язової оболонки артерії (міогенний механізм), а також чутливість останньої до різних біологічно активних речовин (гуморальний механізм).
При венозному застої, обумовленому оклюзією великих шийних вен, надмірне кровонаповнення судин головного мозку усувається шляхом ослаблення припливу крові в його судинну систему внаслідок констрикції всієї системи магістральних артерій. У таких випадках регуляція відбувається також рефлекторно. Рефлекси надсилаються з механорецепторів венозної системи, дрібних артерій і оболонок мозку (віно-вазальний рефлекс).
Система внутрішньомозкових артерій є рефлексогенною зоною, яка в умовах патології дублює роль синокаротидної рефлексогенної зони.
Таким чином, згідно з розробленою концепцією, існують механізми, що обмежують вплив загального АТ на мозковий кровотік, кореляція між якими багато в чому залежить від втручання саморегулюючих механізмів, що підтримують сталість опору мозкових судин. Однак саморегуляція можлива лише в певних межах, обмежених критичними величинами факторів, які є її пусковими механізмами (рівень системного АТ, напруги кисню, вуглекислоти, а також рН речовини мозку та ін.). У клінічних умовах важливо визначити роль початкового рівня артеріального тиску, його діапазону, в рамках якого мозковий кровотік зберігає стабільність. Ставлення діапазону цих змін до початкового рівня тиску (показник саморегуляції мозкового кровотоку) певною мірою визначає потенційні можливості саморегуляції (високий або низький рівень саморгеуляціі).
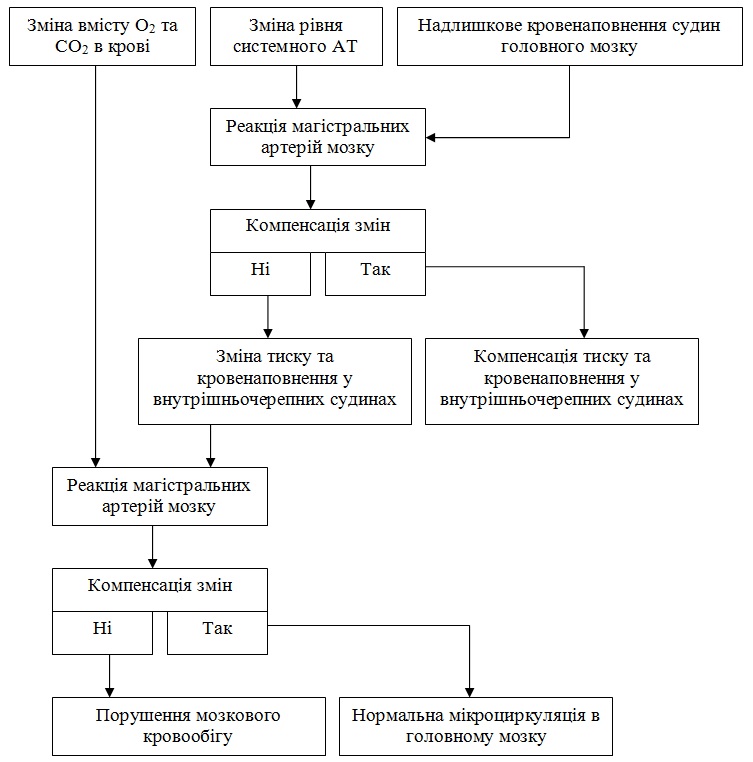
Порушення саморегуляції мозкового кровообігу виникають в наступних випадках.
1. При різкому зниженні загального артеріального тиску, коли градієнт тиску в кровоносній системі мозку зменшується настільки, що не може забезпечити достатній кровообіг у мозку (при рівні систолічного тиску нижче 80 мм рт. ст.). Мінімальний критичний рівень системного АТ дорівнює 60 мм рт. ст. (при початковому - 120 мм рт. ст.). При його падінні мозковий кровотік пасивно слідує за зміною загального артеріального тиску.
2. При гострому значному підйомі системного тиску (вище 180 мм рт. ст.), коли порушується міогенна регуляція, так як м’язовий апарат артерій мозку втрачає здатність протистояти підвищенню внутрішньосудинного тиску, в результаті чого розширюються артерії, посилюється мозковий кровотік, що може призвести до «мобілізації» тромбів і емболії. Згодом змінюються стінки судин, а це веде до набряку мозку і різкого ослаблення мозкового кровотоку, незважаючи на те, що системний тиск продовжує залишатися на високому рівні.
3. При недостатньому метаболічному контролі мозкового кровотоку. Іноді після відновлення кровотоку в ішемізованній ділянці мозку концентрація вуглекислоти знижується, але рН зберігається на низькому рівні внаслідок метаболічного ацидозу. В результаті судини залишаються розширеними, а мозковий кровотік - високим, кисень утилізується не в повній мірі, і відтікаюча венозна кров має червоний колір (синдром надлишкової перфузії).
4. При значному зниженні інтенсивності насичення крові киснем або збільшенні напруги вуглекислоти в мозку. При цьому активність мозкового кровотоку також змінюється слідом за зміною системного АТ.
При зриви механізмів саморегуляції артерії мозку втрачають здатність до звуження у відповідь на підвищення внутрішньосудинного тиску, пасивно розширюються, внаслідок чого надмірна кількість крові під високим тиском направляється в дрібні артерії, капіляри, вени. В результаті підвищується проникність стінок судин, починається вихід білків, розвивається гіпоксія, виникає набряк мозку.
Таким чином, порушення мозкового кровообігу компенсуються до певних меж за рахунок місцевих регуляторних механізмів. Згодом до процесу залучається і загальна гемодинаміка. Однак навіть при термінальних станах протягом декількох хвилин за рахунок автономності мозкового кровообігу в мозку підтримується кровотік, а напруга кисню падає повільніше, ніж в інших органах, так як нервові клітини здатні поглинати кисень при такому низькому парціальному тиску його в крові, при якому інші органи і тканини поглинати його не можуть. У міру розвитку і поглиблення процесу все більш порушуються взаємини між мозковим кровотоком і системною циркуляцією, вичерпується резерв ауторегулюючих механізмів, і кровотік в мозку все більше починає залежати від рівня загального артеріального тиску.
Таким чином, компенсація порушень мозкового кровообігу здійснюється за допомогою тих же регуляторних механізмів, що функціонують в нормальних умовах, але більш напружених.
Для механізмів компенсації характерна подвійність: компенсація одних порушень викликає інші циркуляторні розлади, наприклад, при відновленні кровотоку в тканини, яка зазнала дефіцит кровопостачання, в ній може розвинутися післяішемічна гіперемія у вигляді надлишкової перфузії, що сприяє розвиткові постішеміческого набряку мозку.
Кінцевим функціональним завданням системи мозкового кровообігу є адекватне метаболічне забезпечення діяльності клітинних елементів мозку і своєчасне видалення продуктів їх обміну, тобто процеси, що протікають в просторі мікросудин-клітина. Всі реакції мозкових судин підпорядковані цим головним завданням. Мікроциркуляція в головному мозку має важливу особливість: відповідно до специфіки його функціонування активність окремих областей тканини змінюється майже незалежно від інших областей її, тому мікроциркуляція також змінюється мозаїчно - в залежності від характеру функціонування мозку в той чи інший момент. Завдяки ауторегуляції перфузійний тиск мікроциркуляторних систем будь-яких частин мозку менш залежить від центрального кровообігу в інших органах. У мозку мікроциркуляція посилюється при підвищенні рівня метаболізму і, навпаки. Ті ж механізми функціонують і в умовах патології, коли має місце неадекватність кровопостачання тканини. При фізіологічних і патологічних умовах інтенсивність кровотоку в мікроциркуляторній системі залежить від величини просвіту судин і від реологічних властивостей крові. Однак в нормі регулювання мікроциркуляції здійснюється в основному шляхом активних змін ширини судин, в той час як при патології важливу роль відіграють також зміни плинності крові в мікросудинах.